
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Naposledy zmenené 2025-01-22 17:09.
pKa je podobné pH v tom, že nízke (a dokonca záporné hodnoty) označujú silné kyseliny. Je to preto, že pKa je založená na rovnováhe: Podľa toho čokoľvek, čo stabilizuje konjugovanú bázu, zvýši kyslosť. Preto pKa je tiež meradlom toho, ako stabilný konjugovaná báza je.
Ak vezmeme do úvahy toto, znamená vyššie pKa stabilnejšie?
Urobil viete, že keď je elektronegatívny atóm pripojený blízko ku kyslému vodíku, môže to ovplyvniť pKa ? Elektronegatívny atóm stiahne elektrónovú hustotu, čím pomáha stabilizovať záporný náboj, ktorý zostane po odstránení protónu. Toto znamená základ bude stabilnejšie a výsledkom je silnejšia kyselina.
Ďalej, znamená nižšie pKa silnejšiu kyselinu? Operátor „p“v pKa alebo pH pOH znamená vziať záporný log operandu. Takže čím vyššie pKa a menšie Ka a toto znamená slabší kyselina.
Čo robí základňu stabilnejšou?
A viac " stabilný " základňu bude mať vyššiu elektronegativitu, pretože tento atóm (v tomto prípade F) bude mať vyššiu afinitu k elektrónom, a preto si ich bude „zabíjať“. Toto príčin aby to bolo najstabilnejší všetkých „základov“opísaných vo videu.
Je stabilnejšia silná alebo slabá kyselina?
Konjugovaná báza je stabilnejšie keď je negatívny náboj na elektronegatívnom prvku a keď je náboj delokalizovaný na viacerých atómoch. The stabilnejšie konjugovaná báza, silnejší a kyselina . A veľmi silná kyselina má veľmi slabý konjugovaná báza a veľmi slabá kyselina má veľmi silný konjugovaná báza.
Odporúča:
Aké je pKa amidu?

Zásaditosť. V porovnaní s amínmi sú amidy veľmi slabé zásady. Zatiaľ čo konjugovaná kyselina amínu má pKa približne 9,5, konjugovaná kyselina amidu má pKa približne <0,5. Preto amidy nemajú vo vode také zreteľné acidobázické vlastnosti
Aké je pKa silných kyselín?

Silné kyseliny sú definované ich pKa. Kyselina musí byť vo vodnom roztoku silnejšia ako hydróniový ión, takže jej pKa musí byť nižšie ako pKa hydróniového iónu. Preto silné kyseliny majú pKa <-174
Prečo pufer najlepšie funguje pri pH blízkom jeho pKa?
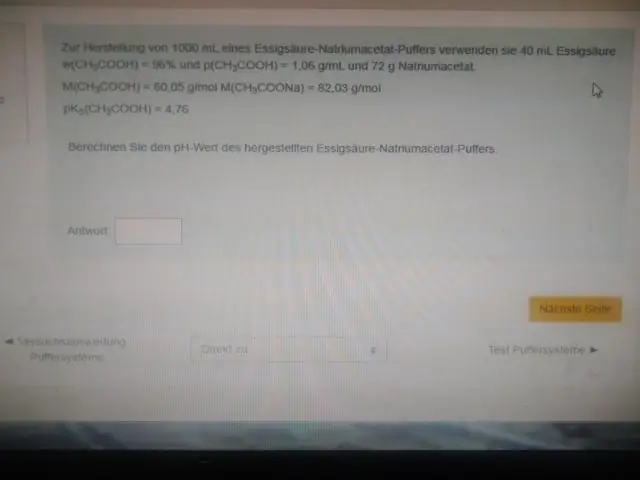
Inými slovami, pH ekvimolárneho roztoku kyseliny (napr. keď pomer koncentrácie kyseliny a konjugovanej zásady je 1:1) sa rovná pKa. Táto oblasť je najúčinnejšia na odolávanie veľkým zmenám pH, keď sa pridá kyselina alebo zásada. Titračná krivka vizuálne demonštruje kapacitu pufra
Aké je približné pKa tiolu?

6.4 Tiež sa pýtali, aké je pKa tiolu? tioly sú kyslejšie ako alkoholy v priemere asi o 5 pKa jednotky alebo tak ( pKa z približne 11 pre tiol na obrázku nižšie). Zapamätaj si to pKa je logaritmický, takže to znamená, že sú asi 10 5 krát kyslejšie.
Čo hovorí pKa o sile kyseliny?

Silné kyseliny sú definované ich pKa. Kyselina musí byť vo vodnom roztoku silnejšia ako hydróniový ión, takže jej pKa musí byť nižšie ako pKa hydróniového iónu. Preto silné kyseliny majú pKa <-174
