
Obsah:
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Naposledy zmenené 2025-01-22 17:09.
V oxidačné číslo metódu, určíte oxidačné čísla všetkých atómov. Potom vynásobíte atómy, ktoré sa zmenili, malým celkom čísla . Celková strata elektrónov sa rovná celkovému zisku elektrónov. Potom ty rovnováhu zvyšok atómov.
Ako teda vyvažujete rovnice redukcie oxidácie?
Na vyváženie jednoduchých redoxných rovníc postupujte podľa týchto pravidiel:
- Napíšte oxidačné a redukčné polovičné reakcie pre druhy, ktoré sú redukované alebo oxidované.
- Vynásobte polovičné reakcie príslušným počtom tak, aby mali rovnaký počet elektrónov.
- Pridajte dve rovnice, aby ste zrušili elektróny.
Po druhé, ako vyvažujete rovnice? Metóda 1 Tradičná rovnováha
- Zapíšte si zadanú rovnicu.
- Napíšte počet atómov na prvok.
- Vodík a kyslík si odložte na koniec, pretože sú často na oboch stranách.
- Začnite s jednotlivými prvkami.
- Použite koeficient na vyváženie jedného atómu uhlíka.
- Ďalej vyvážte atómy vodíka.
- Vyrovnajte atómy kyslíka.
Tiež, ako jednoducho vyvažujete chemické rovnice?
Vo všeobecnosti, aby sme vyvážili rovnicu, musíme urobiť nasledujúce veci:
- Spočítajte atómy každého prvku v reaktantoch a produktoch.
- Použite koeficienty; podľa potreby ich umiestnite pred zlúčeniny.
Je C o2 co2 redoxná reakcia?
je C + O2 = CO2 intramolekulárny redoxná reakcia alebo nie? Jeden reaktant (uhlík) sa oxiduje a druhý redukuje (kyslík). Ide teda o jednoduchú intermolekulu redoxná reakcia . akýkoľvek reakciu v ktorých jeden alebo viac reaktantov/produktov sú čisté prvky, musí byť a redoxná reakcia.
Odporúča:
Ako robíte operácie s celými číslami?

Celé čísla sú celé čísla, kladné aj záporné. Môžete na nich vykonávať štyri základné matematické operácie: sčítanie, odčítanie, násobenie a delenie. Keď pridávate celé čísla, nezabudnite, že kladné celé čísla vás posúvajú na číselnej osi doprava a záporné celé čísla vás posúvajú na číselnej osi doľava
Ako robíte exponenty so zápornými číslami?

Ak sa záporné číslo zvýši na nepárnu mocninu, výsledok bude záporný. Záporné číslo musí byť uzavreté v zátvorkách, aby sa exponent použil na záporný výraz. Exponenty sa zapisujú ako horné indexové číslo (napr. 34) alebo sa pred nimi uvádza symbol vsuvky (^) (napr. 3^4)
Ako súvisí elektrónová konfigurácia s kvantovými číslami?
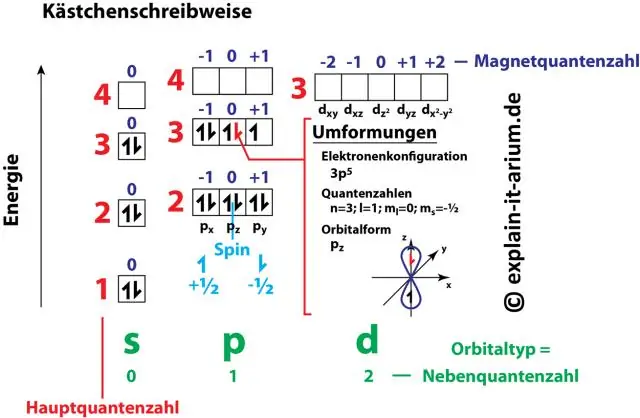
Číselné a písmenové páry v elektrónovej konfigurácii predstavujú dve zo štyroch kvantových čísel elektrónu. Tieto kvantové čísla nám prezradia viac informácií o vlastnostiach elektrónov a ich orbitáloch. Hlavné kvantové číslo (n) nám hovorí o energetickej úrovni elektrónu a jeho veľkosti
Ktoré číslo nie je spoločné medzi prirodzenými číslami a celými číslami?

Nula nemá kladnú ani zápornú hodnotu. Nula sa však považuje za celé číslo, čo z nej robí celé číslo, ale nie nevyhnutne prirodzené číslo
Ako vyvažujete nasledujúce rovnice?

VIDEO V súvislosti s tým, ako vyvažujete chemickú rovnicu? Komu rovnováhu a chemická rovnica , začnite zapisovaním počtu atómov v každom prvku, ktorý je uvedený v dolnom indexe vedľa každého atómu. Potom pridajte koeficienty k atómom na každej strane rovnica do rovnováhu majú rovnaké atómy na druhej strane.
