
- Autor Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- Naposledy zmenené 2025-01-22 17:09.
Izotopy majú rôzne atómové hmotnosti. Relatívna hojnosť každého z nich izotop môže určiť pomocou hmotnostná spektrometria . A hmotnostný spektrometer ionizuje atómy a molekuly vysokoenergetickým elektrónovým lúčom a potom vychyľuje ióny cez magnetické pole na základe ich omša - pomery náboja (m/z m/z m/z).
Ako tu údaje z hmotnostnej spektrometrie demonštrujú existenciu izotopov?
Nie, väčšina prvkov existujú v prírode ako odlišné izotopy toho istého prvku. Keď vzorka čistého prvku je analyzované s a hmotnostný spektrometer , každý izotopová vôľa byť ionizovaný a detekovaný. The omša spektrum predstavuje každý izotop ako vrchol, vykresľovanie jeho omša k pomeru náboja (m/z) a jeho relatívnej intenzite.
Tiež, ako vypočítate priemernú hmotnosť izotopu? Komu vypočítať a priemerná hmotnosť , najprv preveďte percentá na zlomky (vydeľte ich 100). potom vypočítať a omša čísla. Ten chlór izotop s 18 neutrónmi má početnosť 0,7577 a a omša číslo 35 amu.
Ako teda hmotnostná spektrometria identifikuje zlúčeniny?
Najvyšší- omša ión v a spektrum je normálne považovaný za molekulárny ión a nižší- omša ióny sú fragmenty z molekulárneho iónu za predpokladu vzorky je jediný čistý zlúčenina . Aj keď tieto zlúčeniny sú veľkosťou veľmi podobné, to je jednoduchá záležitosť identifikovať ich od ich jednotlivca omša spektrá.
Čo má hmotnosť 1 amu?
Atómová hmotnostná jednotka (symbolizovaná AMU alebo amu) je definovaná ako presne 1/12 hmotnosti atómu uhlíka-12. Atóm uhlíka-12 (C-12) má šesť protóny a šesť neutróny v jeho jadre. Nepresne povedané, jedna AMU je priemerom protón odpočinková hmota a neutrón oddychová omša.
Odporúča:
Je o2 a o3 pár izotopov?

Izotopy sú látky, ktoré majú rovnaký počet protónov, ale líšia sa počtom neutrónov. Dvojica vyššie uvedených izotopov by teda mala byť z rovnakého prvku. O2 a O3 sa líšia v molekulovom vzorci, ale stále pozostávajú z rovnakého druhu atómu, preto sú to alotrópy, zatiaľ čo 32S a 32S2- nie sú izotopy
Čo znamená slovné spojenie boj o existenciu?

Boj o existenciu je prirodzená história [metafora]. Vzťahuje sa na súťaž medzi živými bytosťami o prežitie. Túto a podobnú frázu boj o život použil Charles Darwin viac ako 40-krát v knihe Pôvod druhov a táto fráza je názvom 3. kapitoly knihy Pôvod
Ako fotoelektrický efekt dokazuje dualitu vlnových častíc?
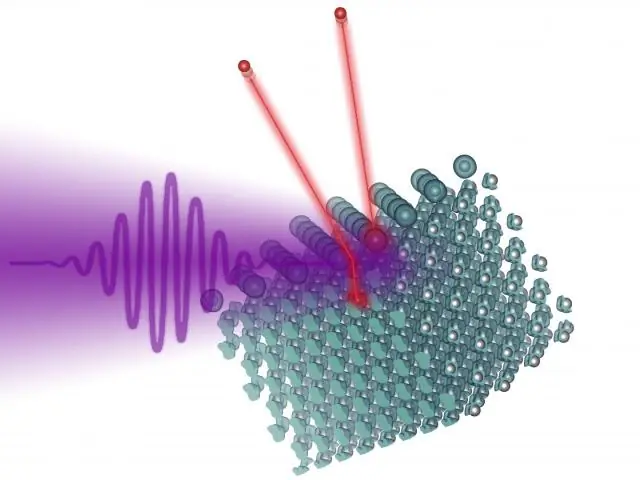
Teória fotoelektrického javu Alberta Einsteina výrazne prispela k De Broglieho teórii a bola dôkazom, že vlny a častice sa môžu prekrývať. Svetlo možno pozorovať aj ako časticu známu ako fotón. Ak teda fotón s väčšou energiou ako elektrón zasiahne pevnú látku, tento elektrón bude emitovaný
Ktorá veta dokazuje, že dve priamky sú rovnobežné?

Ak sú dve čiary prerezané priečnym rezom a zodpovedajúce uhly sú zhodné, potom sú čiary rovnobežné. Ak sú dve čiary prerezané priečnym rezom a striedavé vnútorné uhly sú zhodné, potom sú čiary rovnobežné
Čo dokazuje experiment Millera Ureyho?

V 50. rokoch 20. storočia biochemici Stanley Miller a Harold Urey uskutočnili experiment, ktorý preukázal, že niekoľko organických zlúčenín sa môže spontánne vytvoriť simuláciou podmienok ranej atmosféry Zeme. Elektródy dodávali elektrický prúd, simulujúci blesk, do plynom naplnenej komory
