
- Autor Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Naposledy zmenené 2025-01-22 17:09.
Ten chlór izotop s 18 neutrónmi má početnosť 0,7577 a hmotnostné číslo 35 amu. Na výpočet priemer atómovú hmotnosť, vynásobte zlomok číslom hmotnosti každého z nich izotop a potom ich pridajte spolu.
Podobne, aký je vážený priemer všetkých izotopov prvku?
Pomocou masy rôznych izotopy a aký je každý z nich bohatý izotop je, môžeme nájsť priemer hmotnosť atómov an element . Atómová hmotnosť an element je Vážený priemer hmotnosť atómov v prirodzene sa vyskytujúcej vzorke element . Atómová hmotnosť sa zvyčajne uvádza v jednotkách atómovej hmotnosti.
čo má hmotnosť 1 amu? Atómová hmotnostná jednotka (symbolizovaná AMU alebo amu) je definovaná ako presne 1/12 hmotnosti atómu uhlíka-12. Atóm uhlíka-12 (C-12) má šesť protóny a šesť neutróny v jeho jadre. Nepresne povedané, jedna AMU je priemerom protón odpočinková hmota a neutrón oddychová omša.
Po druhé, ako vypočítate percento výskytu pomocou atómovej hmotnosti?
Zmeňte každý percentuálna hojnosť do desatinnej formy delením číslom 100. Vynásobte túto hodnotu číslom atómová hmotnosť tohto izotopu. Sčítaním pre každý izotop získate priemer atómová hmotnosť.
Aký je rozdiel medzi atómovou hmotnosťou a atómovou hmotnosťou?
Atómová hmotnosť (ma) je omša z an atóm . Slobodný atóm má stanovený počet protónov a neutrónov, takže omša je jednoznačný (nezmení sa) a je súčtom počtu protónov a neutrónov v atóme . Atómová hmotnosť je vážený priemer z omša zo všetkých atómov prvku na základe množstva izotopov.
Odporúča:
Ako interpretujete vážený priemer?

Zhrnutie. Vážený priemer: Priemer, kde niektoré hodnoty prispievajú viac ako iné. Keď sa váhy pripočítajú k 1: jednoducho vynásobte každú váhu zodpovedajúcou hodnotou a všetko spočítajte. V opačnom prípade vynásobte každú váhu w jej zodpovedajúcou hodnotou x, sčítajte to všetko a vydeľte súčtom váh: Vážený priemer = ΣwxΣw
Ako zistíte chýbajúce číslo, keď je uvedený priemer?

Priemer množiny čísel je priemer týchto čísel. Význam môžete nájsť sčítaním množiny čísel a delením koľkými zadanými číslami. Ak dostanete priemer a požiadate o nájdenie chýbajúceho čísla zo sady, použite jednoduchú rovnicu
Ako zistíte štandardnú odchýlku a priemer v Exceli?
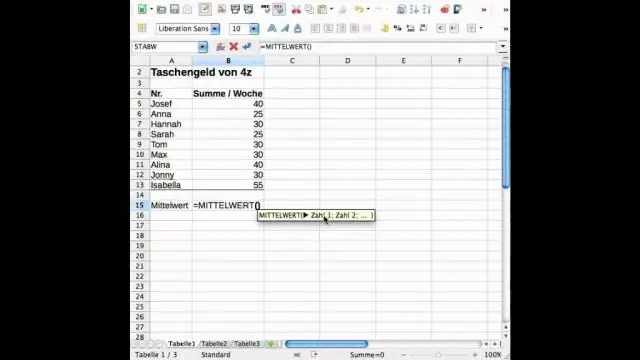
Smerodajná odchýlka je mierou toho, aká veľká je odchýlka v množine čísel v porovnaní s priemerom (priemerom) čísel. Na výpočet štandardnej odchýlky v Exceli môžete použiť jednu z dvoch základných funkcií v závislosti od množiny údajov. Ak údaje predstavujú celú populáciu, môžete použiť STDEV. Funkcia P
Ako vytvoríte vážený priemer v kontingenčnej tabuľke?

Vážené priemery v kontingenčnej tabuľke Kliknite na šípku nadol vedľa slova kontingenčná tabuľka na ľavej strane panela s nástrojmi kontingenčnej tabuľky. Vyberte Vzorce | Vypočítané polia. Do poľa Názov zadajte názov nového poľa. Do poľa Vzorec zadajte vzorec, ktorý chcete použiť pre váš vážený priemer, napríklad =WeightedValue/Weight. Kliknite na tlačidlo OK
Ako zistíte priemer v grafe?
Ak chcete nájsť priemer, sčítajte čísla a vydeľte súčet počtom sčítancov
